抗体和疫苗的糖基化修饰服务
在众多的蛋白质翻译后修饰中,糖基化修饰是最重要和最复杂的修饰之一,也是评价抗体的关键质量属性之一。单抗药物功能的实现与其糖基化修饰密切相关,糖基化修饰会影响蛋白的性能,如构象、稳定性、溶解度、药物代谢动力学、活性及免疫原性。本文中,笔者就糖基化及其对抗体药物的稳定性/半衰期、安全性及生物活性进行了简要概述。
糖基化是蛋白质重要的翻译后修饰之一,根据糖基化的修饰位点可将糖基化分为N位糖基化和O位糖基化。N位糖基化位于Asn-297,寡糖中的N-乙酰氨基葡萄糖与天冬酰胺残基上的酰胺氮连接修饰蛋白,起始于内质网完成于高尔基体;O位糖基化由寡糖中的N-乙酰半乳糖与丝氨酸或苏氨酸残基上的羟基连接修饰蛋白,在高尔基体完成。
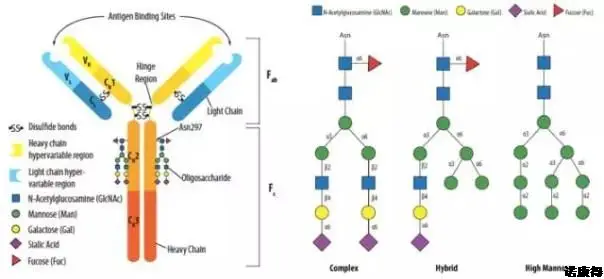
动物细胞分泌的免疫球蛋白中N位的糖基化是最普遍的糖基化修饰,同时也是研究最多的一种糖基化修饰。以IgG1为例,其重要的糖基化修饰位点位于Fc端,且根据其末端精细结构(长度、分支及单糖排列)的不同又可分为复合型、杂合型和高甘露糖型,如图1所示。
图1 单抗中N位糖基化的位置(左)及其三种主要类型(右)
在图1中可以看到IgG1的糖基化修饰为复合型,其糖基化以岩藻糖(Fuc)为核心,再由N-乙酰氨基葡萄糖(N-GlcNAc)分出两条等长的分支,其分支上伴以甘露糖(Man)、半乳糖(Gal)和唾液酸(Sia),由此构成IgG1的Fc端N位糖基化。根据两条分支中的单糖不同,可将IgG1的糖基化修饰类型分为表1中的不同糖型,正是由其糖型的不同导致单抗的免疫原性、生物活性、药物动力学等的不同。
表1 IgG1的Fc端糖基化修饰类型
上一篇:没有了
下一篇:没有了
下一篇:没有了
推荐文章
- 癌症免疫疗法的新型递送平台
免疫疗法已经改变了治疗癌症的范例,这些疗法旨在提高抗肿瘤免疫反应,以通过自然机制攻击癌细胞,减少脱靶(of......
- 涨姿势:肿瘤生物治疗
- CAR-NK:癌症免疫疗法“新星”冉冉升起
热门标签